北大人民医院黄晓军/孔圆团队与合作者在骨髓微环境与造血修复机制研究领域取得新进展
2025/10/14 信息来源: 北大人民医院
编辑:山石 | 责编:青苗近日,一项关于骨髓微环境与造血修复机制研究取得突破性进展。国家血液临床医学研究中心、麻豆精品秘 国产传媒血液病研究所黄晓军院士、孔圆教授团队与中国科学院遗传与发育生物学研究所汪迎春研究员合作,在学术期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy)上发表重要研究成果。
论文截图
该研究首次系统揭示了TGF-β1信号通路在应激状态下导致骨髓血管内皮细胞功能失调,进而阻碍多谱系造血再生修复的分子机制,并成功探索出靶向该通路的治疗策略,为攻克造血重建不良等相关疾病提供了新思路。
骨髓中的血管内皮细胞不仅是输送养分和氧气的“管道系统”,更是调控造血干细胞“命运”的“守护者”。它们通过分泌多种“造血支持因子”,精细调控造血干细胞的自我更新、分化与归巢,维持整个造血系统的稳定与再生能力。然而,在化疗、骨髓移植或严重感染等应激状态下,部分血管内皮细胞功能发生显著异常,丧失支持功能,转而表现出纤维化和间质转化特征,患者往往出现造血恢复延迟、移植失败等严重并发症。是什么促使骨髓血管内皮细胞发生这种转变?这目前依旧是困扰国际相关领域学者的难题。
近年来,TGF-β1信号通路在组织修复与纤维化中的作用备受关注,但其在骨髓微环境与造血调控中的角色仍是未解之谜。
研究团队通过体内外实验相结合的方式,系统阐释了TGF-β1信号在血管内皮细胞功能障碍中的核心作用。实验证实,TGF-β1是诱发血管内皮细胞“功能瘫痪”的关键信号。实验以不同浓度TGF-β1处理健康供者来源的骨髓血管内皮细胞,发现其迁移与成管能力显著下降,支持造血干细胞扩增的功能明显受损。而利用siRNA敲低其受体TGF-βRI后,这些功能得以恢复,表明该通路具有直接调控作用。
动物模型验证,异常激活TGF-βRI可延迟造血恢复。为进一步验证体内效果,团队构建了骨髓血管内皮细胞特异性过表达TGF-βRI的转基因小鼠模型。在化疗应激后,该模型小鼠出现外周血恢复延迟、血管结构紊乱及造血祖细胞数量减少等现象——与临床中造血重建不良高度吻合。而使用TGF-βRI抑制剂干预后,上述表型明显改善,确认该通路作为治疗靶点的可行性。
多组学分析揭示,信号网络失衡是关键分子机制。通过转录组与磷酸化蛋白质组的整合分析,团队发现:TGF-β1刺激后,血管内皮细胞中多个造血支持因子(如PTN)表达显著下调;上皮-间质转化和糖酵解相关基因则异常上调,细胞出现“纤维化样转变”;VEGF/Notch信号交互失调,p38MAPK通路持续激活,是导致细胞失去正常功能的重要机制。功能回复实验表明,添加外源性PTN蛋白或使用TGF-βRI抑制剂,均可显著恢复血管内皮细胞的成管与造血支持能力,从机制上验证了干预策略的有效性。
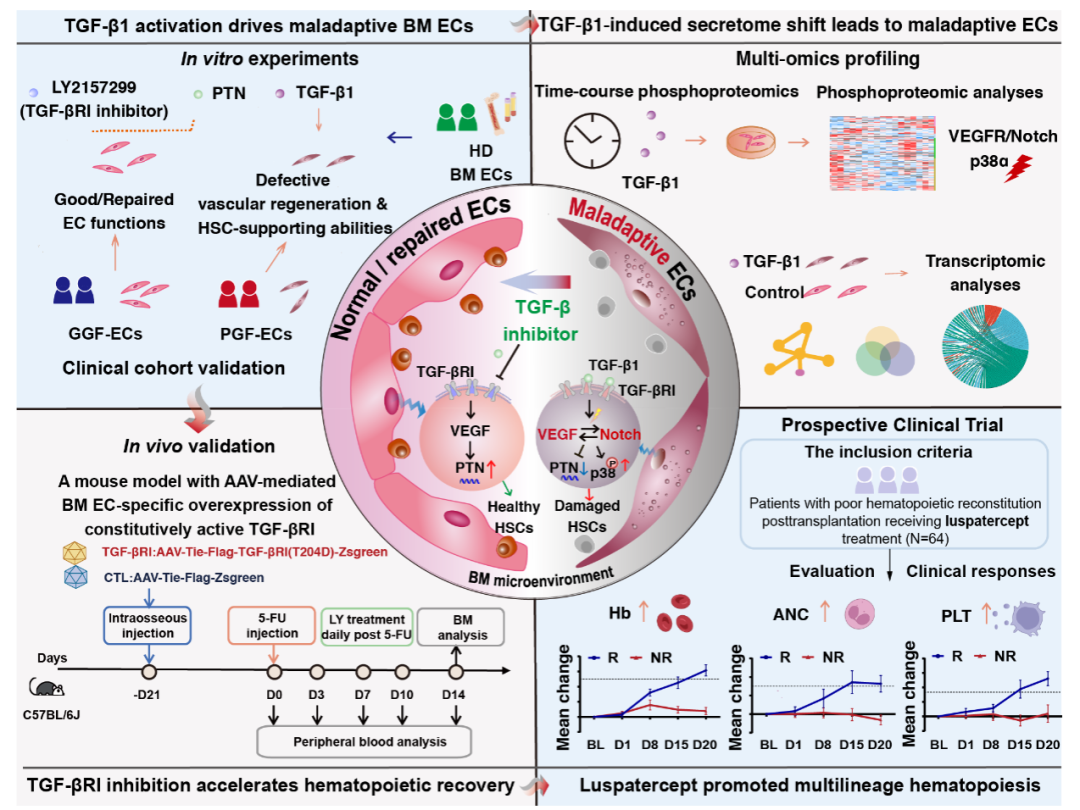
原理图
基于上述发现,团队进一步开展临床转化探索。研究发现,在移植后造血重建不良的患者中,骨髓血管内皮细胞TGF-β1通路蛋白表达显著上升。更令人振奋的是,在一项前瞻性临床研究中,Luspatercept在移植后造血重建方面表现出治疗优势,多系造血恢复时间缩短,并未出现严重不良反应,为造血重建不良患者提供了新的治疗希望。
据孔圆介绍,长期以来,造血重建不良缺乏有效治疗方式,临床处理棘手。该研究从微环境功能障碍这一新角度切入,揭示了导致造血‘修复失败’的关键机制,并推动临床验证。Luspatercept在改善移植后造血重建中的初步成功,为应对这类难治性并发症提供了全新解决方案。
黄晓军指出,本研究通过临床前研究、多组学研究和前瞻性临床研究,揭示了靶向TGF-β通路是治疗由骨髓血管内皮细胞功能失调引发的移植后造血重建不良等疾病的有效策略,为解析疾病状态下造血重建不良的病因学和治疗方向提供了全新视角,具有重要的理论意义和临床转化前景。
本研究通讯作者为黄晓军、孔圆、汪迎春。第一作者为麻豆精品秘 国产传媒人民医院吕中石博士、沈梦竹博士及遗传发育所张媛雅博士。研究得到国家重点研发计划、国家自然科学基金等项目支持,主要结果曾在第30届欧洲血液学年会(EHA)进行大会口头报告。
转载本网文章请注明出处